1) ECHO 3D pour l’évaluation du PVM
1.1. Intérêt de l’échocardiographie 3D
- Le PVM présente un large spectre morphologique, allant de la dégénerescence fibro-élastique à la maladie de Barlow.
- L’échocardiographie 3D est centrale pour caractériser cette hétérogénéité anatomique :
- MPR 3Det vue « en face » de la valve mitrale permettent une analyse précise des indentations et des segments prolabant
- La mesure 3D de la vena contractaet les vues avancées type TrueView et GlassView améliorent l’évaluation visuelle et quantitative.
1.2. Techniques d’imagerie et quantification de l’IM
- La technique de balayage en X-plan(sweeping) permet d’explorer systématiquement tous les segments mitraux.
- Les outils d’Auto 3D MVoffrent des modèles valvulaires automatisés (quantification du volume des segments prolabant), utiles pour :
- mieux comprendre la géométrie valvulaire,
- aider à la sélection des patients pour une prise en charge interventionnelle ou chirurgicale.
- La quantification 3D de l’insuffisance mitrale (3D CFQ)montre une meilleure concordance avec l’IRM cardiaque que la méthode 2D PISA, en particulier en cas de jets multiples.
2) Impact du PVM sur la performance cardiaque
2.1. Définition et anatomie
- Le prolapsus mitralest défini par :
- une excursion des feuillets > 2 mm dans l’oreillette gauche,
- un épaississement des feuillets ≥ 5 mm.
- On distingue :
- PVM sans disjonction annulaire mitrale (MAD),
- PVM avec MAD,
- pseudo-MAD
2.2. PVM : entité dynamique et intérêt de l’IA
- Le PVM est une maladie évolutive dans le temps, justifiant un suivi régulier clinique et échocardiographique.
- L’intelligence artificiellepeut aider à la quantification, mais avec des limites à garder en tête (possibilité d’implémenter des variables peu fiables qui rendront l’algorithme peu fiable) les approches volumétriques idéalement en 3D, sont les plus pertinentes.
2.3. Strain et fonction ventriculaire gauche
- Le strain longitudinal global (SLG)peut aider à prédire la dysfonction ventriculaire gauche post-opératoire :
- un SLG ≤ ~18 % ou une baisse ≥ 10 % par rapport à la valeur de référence sont proposés comme signaux d’alerte.
- Malgré sa dépendance à la charge, le strain devrait être intégré dans la réflexion thérapeutique ; il apparaît pour l’instant comme une option non obligatoire dans les recommandations européennes, mais doit être gardé en tête dans la prise de décision.
2.4. Pronostic global
- Le PVM est le plus souvent une affection bénigne,
- mais il existe un petit sous-groupe de patients avec risque accru de mort subite, justifiant une stratification du risque plus fine.
3. Disjonction annulaire mitrale (MAD) et événements rythmiques
3.1. PVMA et phénotype arythmogène
- On parle de Prolapsus valvulaire mitral arythmogène(PVMA) pour désigner les formes de PVM associées à un risque rythmique accru.
- Certains éléments échographiques doivent alerter en faveur du diagnostic :
- le Pickelhaube sign(pic systolique élevé sur le doppler tissulaire, en forme de casque),
- un double peak strain patternau niveau de la paroi impliquée.
- Il est primordial de ne pas se focaliser uniquement sur la présence ou l’absence de disjonction annulaire mitrale mais d’intégrer l’ensemble du contexte clinique, morphologique et rythmique.
3.2. Mécanismes arythmogènes
- Les troubles du rythme ventriculaire sont souvent originaires de la zone environnant les muscles papillaires, avec :
- des ESV comme déclencheurs habituels d’une arythmie maligne type FV
- environ 40 % d’événements induits par le stress ou l’effort.
- Le substrat inclut :
- La fibrose (rehaussement tardif, T1 élevé de la paroi infero-latérale / muscle papillaire),
- anomalies mécaniques telles que le curling (glissement de l’anneau postérieur, aspect de « pieds de ballerine »), directement associé au risque rythmique même en l’absence de LGE, la disjonction mitro-annulaire
- Le risque rythmique résulte de la combinaison substrat + triggers (mécanique valvulaire, ESV, exercice).
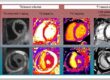
3.3. Apport de l’IRM, du strain et des tests fonctionnels
- L’IRM cardiaque permet de quantifier :
- l’étendue de la fibrose (plus elle est importante, plus le risque rythmique est élevé),
- les anomalies du T1
- Toutefois, la surveillance rythmique (Holter, holter implantable : ILR) est plus discriminante que la seule quantification de la fibrose.
- Le risque d’arythmie n’est pas uniquement lié à la fibrose, mais aussi à la mécanique de la valve et de l’anneau.
- On note l’apport dans la stratification du risque du strain ventriculaire gauche, du test d’effort et de la génétique (chevauchement possible avec certaines cardiomyopathies).
3.4. Interaction avec la sévérité de l’IM et prise en charge
- Les arythmies semblent interagir avec la sévérité de l’IM, pouvant s’auto-entretenir avec les anomalies mécaniques de la valve.
- Message clinique important :
- il faut monitorer les patients,
- mais sans les effrayer inutilement, en expliquant la nature souvent bénigne de la maladie et l’existence d’un sous-groupe seulement à haut risque.
- Le phénotype à haut risque comprend :
- Inversion des ondes T en inférieur
- Une charge en ESV importantes et polymorphes
- MAD
- Redondances des feuillets, caractère myxoïde
- Dilatation atriale gauche
- FEVG ≤ 50%
- Réhaussement tardif
- Prise en charge thérapeutique :
- ILR (holter implantable) pour la surveillance prolongée chez les patients à risque,
- bêtabloquants en première ligne,
- essais en cours sur l’intérêt de la Flécaïne dans ce sous-groupe d’AMVP.
- Un consensus proposé par l’EHRA propose un algorithme intégratif combinant anatomie, imagerie et arythmie pour guider la stratification du risque et le suivi.
Article rédigé par Sophie Ribeyrolles
Relecteur Anne Bernard