Le développement et l’utilisation de la tomographie par émission de positons (TEP) en cardiologie demeurent aujourd’hui relativement limités. Cette diffusion restreinte ne tient toutefois pas à un manque de pertinence clinique, mais essentiellement à des contraintes d’accès et de coûts. Pourtant, la TEP dispose d’atouts uniques, en particulier sa capacité à fournir une information sur le métabolisme cellulaire impliqué dans différents mécanismes physiopathologiques, comme le métabolisme glucidique des cellules de l’inflammation dans l’endocardite et la sarcoïdose.
En ce sens, la principale limite de la TEP ne réside pas dans la technique elle-même, mais dans l’identification de radiotraceurs capables de cibler de manière pertinente les processus biologiques d’intérêt clinique.
Les perspectives d’évolution de la TEP en cardiologie reposent ainsi avant tout sur la capacité à développer des radiotraceurs ciblant de manière spécifique et innovante les différentes cascades physiopathologiques cardiovasculaires. Si certains de ces marqueurs demeurent au stade de la preuve de concept, d’autres apparaissent d’ores et déjà comme particulièrement prometteurs, laissant entrevoir des perspectives d’application clinique.
Le congrès de l’EACVI 2025 à Vienne a été l’occasion de faire le point sur plusieurs de ces avancées.
Le 18F-flurpiridaz : du nouveau dans la perfusion myocardique
Bien que la TEP reste encore sous-utilisée comme test d’ischémie myocardique, son intérêt dans l’évaluation de la perfusion myocardique est solidement établi. Elle offre une excellente résolution spatiale et permet une quantification du débit myocardique et de la réserve de flux coronaire, déjà démontrée avec des traceurs tels que le 82Rb ou le 13N-ammoniac. Néanmoins, l’accès à ces radiotraceurs demeure souvent conditionné à des infrastructures lourdes, telles que des générateurs sur site ou des cyclotrons locaux, et s’accompagne de coûts d’investissement et de fonctionnement élevés, limitant leur diffusion à grande échelle.
Le 18F-flurpiridaz constitue une avancée déterminante. Ce radiotraceur se lie au complexe mitochondrial I, particulièrement abondant dans les cardiomyocytes, ce qui lui confère une extraction myocardique de premier passage très élevée, de l’ordre de 94 % (1). Associée à la courte portée des positons du fluor-18, cette propriété se traduit par une amélioration significative de la résolution spatiale et de la qualité d’image par rapport aux traceurs TEP actuellement utilisés (2). Sa demi-vie prolongée de 109 minutes permet une production centralisée avec distribution en doses unitaires, levant ainsi un frein logistique majeur à l’essor de la TEP de perfusion myocardique. Elle autorise également la réalisation de protocoles d’effort physique, offrant une évaluation conjointe de la perfusion myocardique et de la réponse physiologique à l’exercice (1).
Le 18F-flurpiridaz a récemment obtenu une autorisation de la FDA. Les études cliniques démontrent une supériorité diagnostique pour la détection des lésions coronaires significatives par rapport à la scintigraphie myocardique au technétium-99m en lien avec une amélioration de la qualité des images et de la certitude diagnostique du clinicien avec une exposition aux rayonnements inférieure. Ces bénéfices ont été confirmés dans des sous-groupes traditionnellement sources de faux positifs, tels que les femmes et les patients obèses (3).
Au-delà de la détection de la maladie coronaire épicardique, l’extraction myocardique quasi linéaire du 18F-flurpiridaz sur une large gamme de débits limite l’effet de « roll-off » observé avec d’autres traceurs et permet une quantification précise du débit myocardique, y compris à l’effort (1). Ces caractéristiques ouvrent des perspectives majeures pour l’évaluation des dysfonctions microcirculatoires et renforcent la place potentielle de la TEP comme outil de référence pour une évaluation complète de l’ischémie myocardique.
L’imagerie FAP : les fibroblastes avant la fibrose
La fibrose myocardique est aujourd’hui reconnue comme un déterminant majeur du développement et de la progression de l’insuffisance cardiaque. Elle constitue un point de convergence physiopathologique commun à l’ensemble des cardiopathies, quelle qu’en soit l’étiologie. Sa détection précoce et sa caractérisation dynamique représentent ainsi un enjeu central de l’imagerie cardiovasculaire moderne.
Les radiotraceurs ciblant la Fibroblast Activation Protein (FAP), initialement développés en oncologie pour l’imagerie du stroma tumoral, ne disposent pas à ce jour d’une approbation de la FDA et sont utilisés dans le cadre d’essais cliniques. La FAP est exprimée par les fibroblastes activés, cellules clés responsables de la production de matrice extracellulaire. L’imagerie TEP-FAP permet ainsi de visualiser un processus biologiquement actif, en amont de la fibrose constituée classiquement détectée par le rehaussement tardif en IRM.
Cette approche offre un intérêt pronostique potentiel en identifiant des cardiopathies en cours de progression. Elle ouvre également des perspectives thérapeutiques encore hypothétiques mais particulièrement attractives. L’intervalle entre l’activation fibroblastique et l’apparition d’une fibrose irréversible pourrait en effet constituer une véritable fenêtre d’intervention pour des stratégies visant à moduler la fibrogenèse myocardique.
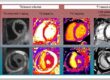
Chez les patients ayant présenté un infarctus du myocarde, l’imagerie TEP-FAP met en évidence un signal intense en phase aiguë, dont l’étendue dépasse la zone infarcie. Ce signal décroît progressivement au cours du temps et devient absent au stade chronique. L’intensité du signal FAP en phase post-aiguë est par ailleurs associée au risque de remodelage ventriculaire gauche défavorable (4).
Sur le plan préclinique, des données issues de modèles murins, encore non publiées, suggèrent que le traitement par énalapril en phase post-infarctus s’accompagne d’une réduction significative du signal FAP. Ces résultats soutiennent l’hypothèse d’un rôle de la TEP-FAP comme biomarqueur d’efficacité thérapeutique des stratégies antifibrosantes. Par ailleurs, des approches expérimentales associant le ciblage de la FAP à des thérapies cellulaires dirigées contre les fibroblastes activés ont été proposées et sont actuellement en cours d’évaluation.
Au-delà de l’infarctus du myocarde, les champs d’application de l’imagerie TEP-FAP sont nombreux et font l’objet d’investigations croissantes, notamment dans les cardiomyopathies, les cardiopathies valvulaires et la cardiotoxicité liée aux traitements oncologiques.
Enfin, l’association d’une imagerie TEP au 18F-FDG et d’un traceur ciblant la FAP, dans le cadre d’une approche dite de TEP double traceur, permet de dissocier l’inflammation active de l’activation fibroblastique. Dans les cardiomyopathies inflammatoires, cette combinaison offre une lecture intégrée du continuum inflammation–fibrose et pourrait contribuer à l’identification de territoires myocardiques à haut risque évolutif.
Le 18F-GP1 : la traque du thrombus
Le 18F-GP1 est un radiotraceur développé pour l’imagerie de la thrombose active et utilisé à ce jour dans le cadre d’essais cliniques. Il s’agit d’un dérivé de l’élarofiban, antagoniste de la glycoprotéine IIb/IIIa. Le 18F-GP1 cible spécifiquement la conformation activée de ce récepteur, exprimée uniquement à la surface des plaquettes activées au sein des thrombi récents (5).
Cette spécificité lui confère une capacité unique à imager une thrombose biologiquement active. Contrairement aux approches morphologiques classiques, il permet de différencier un thrombus récent et potentiellement emboligène d’un thrombus ancien et organisé. Il s’agit ainsi d’un véritable marqueur de la « vulnérabilité thrombotique ».
Les premières études ont montré une fixation myocardique physiologique très faible, une absence quasi totale de bruit de fond vasculaire et une excellente visualisation des thrombi de petite taille (5). Cette distribution favorable rend le 18F-GP1 particulièrement adapté à l’imagerie corps entier, permettant d’identifier simultanément la source emboligène et les localisations secondaires dans une approche globale de la maladie thrombo-embolique.
Les AVC ischémiques de cause indéterminée restent fréquents et exposent à un risque de récidive significatif. Dans ce contexte, l’imagerie corps entier par 18F-GP1 apparaît prometteuse. Des données non publiées présentées par Whittington B. et Balmforth C. rapportent une reclassification étiologique dans 26 % des cas, permettant d’identifier une origine thrombo-embolique chez 43 % des AVC initialement cryptogéniques, tandis que l’absence de fixation est associée à un risque de récidive nettement plus faible.
En cardiologie, les applications potentielles du 18F-GP1 sont nombreuses et concernent des situations cliniques complexes. Il permet d’identifier une activité thrombo-plaquettaire au sein de plaques coronaires ou carotidiennes non sténosantes, ouvrant la voie à une imagerie de la plaque dite « vulnérable ». Il apporte également une aide précieuse dans l’évaluation des dispositifs intracardiaques en distinguant une thrombose active d’une réaction fibreuse. Dans l’endocardite infectieuse, le 18F-GP1 constitue un complément intéressant aux traceurs inflammatoires en ciblant spécifiquement la composante thrombo-plaquettaire des végétations. Enfin, ce radiotraceur pourrait contribuer à la détection de thrombi intermittents ou transitoires dans la fibrillation atriale, à l’exploration des MINOCA et à l’évaluation des indications de fermeture de foramen ovale perméable, renforçant ainsi son rôle potentiel dans une approche intégrative des pathologies thrombo-emboliques cardiovasculaires.
Conclusion
Ces trois radiotraceurs illustrent l’évolution de la TEP en cardiologie vers une imagerie à la fois fonctionnelle, cellulaire et moléculaire. En ciblant respectivement la perfusion myocardique, la fibrose en formation et la thrombose active, ils dépassent la simple évaluation anatomique pour s’inscrire dans une médecine cardiovasculaire plus personnalisée, intégrant diagnostic, pronostic et orientation thérapeutique.
Article rédigé par Alex Melot
Relecteur : Nicolas Piriou
Bibliographie
- Maddahi J, Packard RR. Cardiac PET perfusion tracers: current status and future directions. Semin Nucl Med. 2014;44(5):333-343.
- Alwan M, El Yaman A, Al Rifai M, Al-Mallah MH. PET MPI With F-18 Flurpiridaz Versus Rb-82: Insights Into Blood Flow and Splenic Switch-Off. JACC Case Rep. 2025 Sep 24;30(29):105229.
- Maddahi J, Lazewatsky J, Udelson JE, et al. Phase-III clinical trial of fluorine-18 flurpiridaz positron emission tomography for evaluation of coronary artery disease. J Am Coll Cardiol. 2020;76(4):391-401.
- Barton AK, Craig NJ, Loganath K et al. Myocardial Fibroblast Activation After Acute Myocardial Infarction: A Positron Emission Tomography and Magnetic Resonance Study. J Am Coll Cardiol. 2025 Feb 18;85(6):578-591.
- Whittington B, Tzolos E, Joshi S et al. Qualitative and quantitative analysis of 18F-GP1 positron emission tomography in thrombotic cardiovascular disease. Sci Rep. 2024 Nov 5;14(1):26792.