La sarcoïdose est une maladie inflammatoire caractérisée par la formation de granulomes épithélioïdes et gigantocellulaires sans nécrose caséeuse, pouvant infiltrer de nombreux organes dont le cœur. La sarcoïdose cardiaque survient le plus souvent dans le cadre d’une atteinte systémique, mais elle peut également représenter la manifestation inaugurale, voire isolée, de la maladie. Son expression clinique est très hétérogène, allant de formes totalement asymptomatiques à la mort subite, ce qui rend son diagnostic complexe et confère à l’imagerie cardiaque multimodale un rôle central.
Ce résumé s’appuie sur la présentation du Dr Konstantina Mitrousi lors du congrès de l’EACVI à Vienne, s’appuyant lui-même sur le consensus d’experts de l’ESC publié en 2024 (1).
- Démarche diagnostique
Le diagnostic de certitude de sarcoïdose cardiaque repose sur l’analyse histologique d’une biopsie endomyocardique. Cependant, cet examen est invasif et peu sensible en raison du caractère focal des lésions. En pratique, le diagnostic est le plus souvent établi sur un faisceau d’arguments cliniques et d’imagerie, idéalement complétés par une biopsie extracardiaque lorsqu’elle est réalisable.
Deux modes de présentation conduisent à envisager le diagnostic : les patients ayant une sarcoïdose extra-cardiaque confirmée, et les patients présentant des manifestations cardiaques inaugurales inexpliquées.
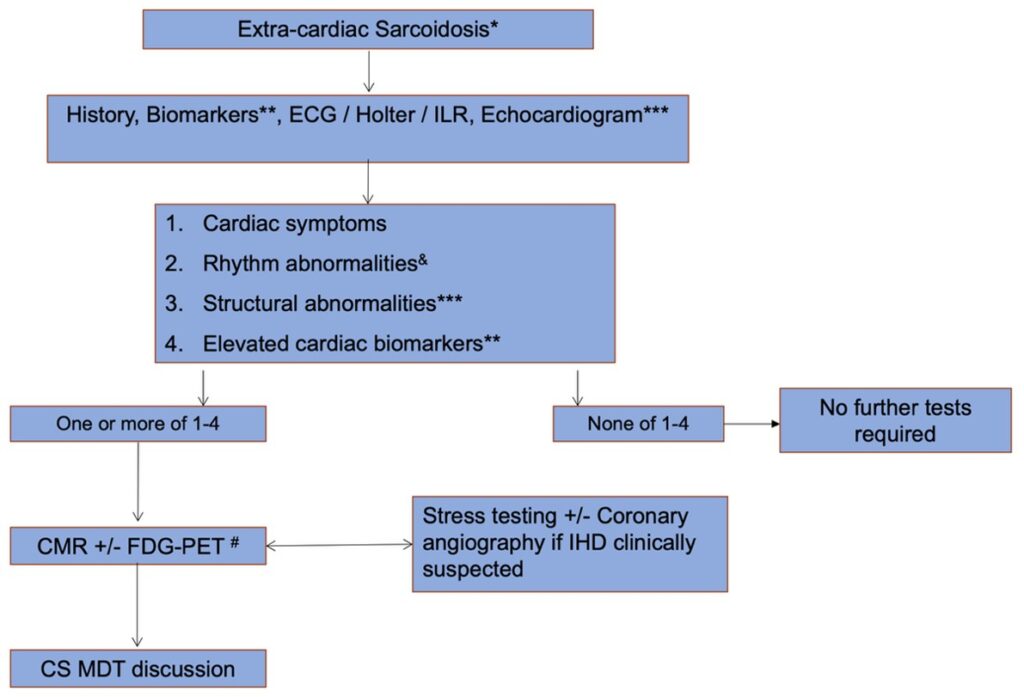
Chez les patients présentant une sarcoïdose extracardiaque confirmée, une évaluation cardiologique initiale est recommandée et comprend la recherche de signes fonctionnels, le dosage des biomarqueurs cardiaques (troponines, NT-proBNP), la réalisation d’un ECG (± holter ECG), et d’une ETT (Figure 1). En cas d’anomalies, le bilan est complété par une IRM cardiaque, une TEP au ¹⁸F-FDG et la recherche d’une coronaropathie si celle-ci est suspectée. La probabilité diagnostique de sarcoïdose cardiaque, intégrant l’ensemble de ces données, est ensuite discutée au sein d’une équipe pluridisciplinaire.
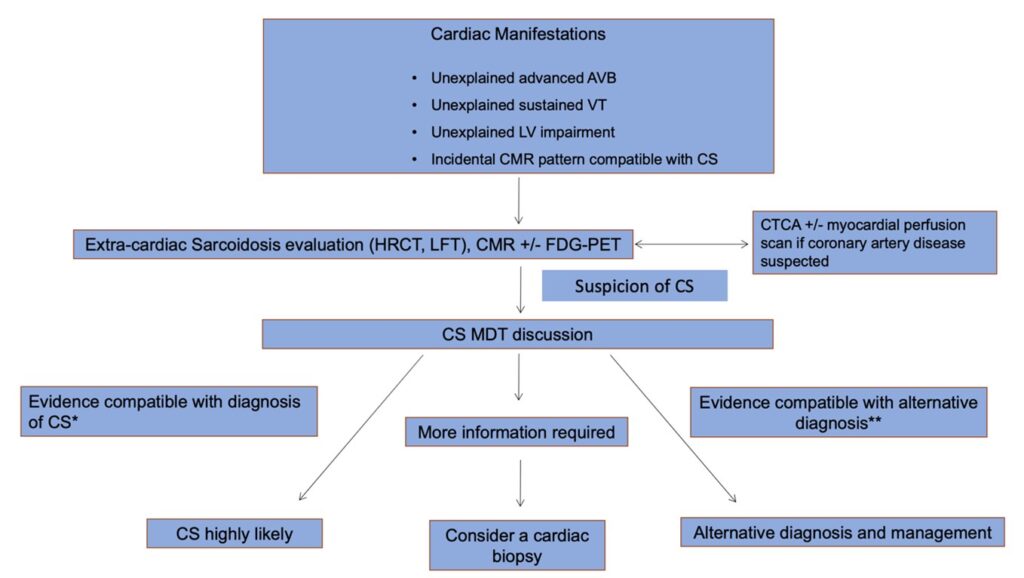
Chez les patients présentant des manifestations cardiaques sans cause évidente retrouvée (BAV de haut grade, tachycardie ventriculaire soutenue ou insuffisance cardiaque), une IRM cardiaque est recommandée afin d’exclure une sarcoïdose cardiaque, complétée par une TEP au ¹⁸F-FDG. La découverte fortuite à l’IRM cardiaque d’anomalies évocatrices de sarcoïdose justifie également une évaluation spécifique, incluant la recherche d’une atteinte extracardiaque. La probabilité diagnostique de sarcoïdose cardiaque est ensuite discutée en réunion pluridisciplinaire.
2. Imagerie cardiaque dans la sarcoïdose : approche multimodale
2.1. Échocardiographie transthoracique
L’échocardiographie transthoracique est l’examen d’imagerie de première ligne dans l’évaluation de la sarcoïdose cardiaque, avec une spécificité élevée (95 %) mais une mauvaise sensiblité (25 %), en particulier aux stades précoces. Les anomalies évocatrices incluent des troubles de la cinétique segmentaire non systématisés, une altération du strain longitudinal global, des atteintes pariétales notamment du septum basal (épaississement lié à l’œdème ou à l’infiltration granulomateuse, puis amincissement secondaire à la fibrose), ainsi qu’une dysfonction diastolique, fréquente mais non spécifique.
2.2. IRM cardiaque
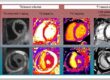
L’IRM occupe une place centrale en cas de suspicion de sarcoïdose cardiaque, en raison d’une sensibilité supérieure à celle de l’ETT. Elle permet une analyse morphologique et fonctionnelle du ventricule gauche, la détection d’un œdème myocardique (séquences T2-STIR et cartographie T2), ainsi que l’identification de fibrose ou de lésions granulomateuses grâce aux séquences de rehaussement tardif. Elle peut également révéler une atteinte extracardiaque ou orienter vers un diagnostic différentiel.
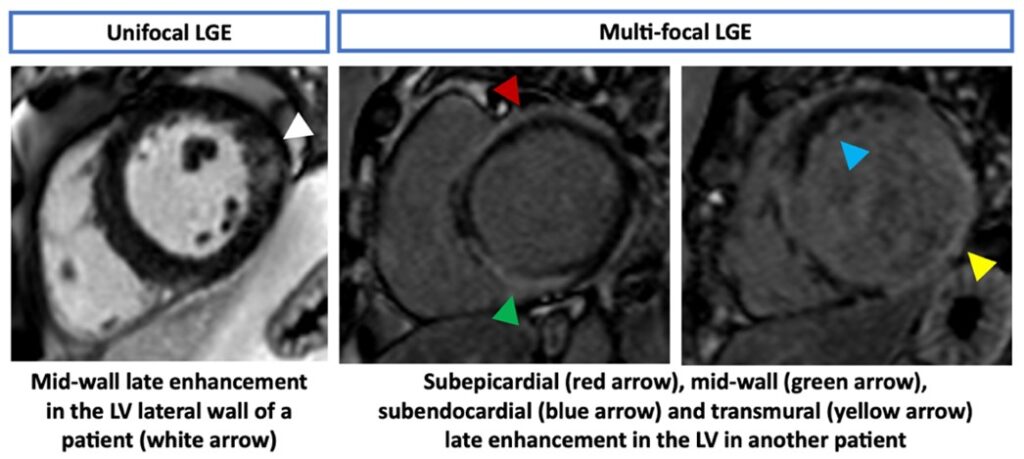
Le diagnostic repose principalement sur le rehaussement tardif, typiquement intramyocardique ou sous-épicardique, souvent irrégulier, nodulaire et multifocal, avec une prédilection pour les segments basaux de la paroi latérale ou du septum interventriculaire, bien que les présentations soient hétérogènes (Figure 3).
2.3. TEP au ¹⁸F-FDG
La TEP au ¹⁸F-FDG est recommandée dans le bilan diagnostique de la sarcoïdose cardiaque suspectée. Complémentaire de l’IRM, elle apporte des informations essentielles sur la localisation, l’activité, le stade et l’étendue de la maladie. Elle permet également d’identifier des atteintes extracardiaques accessibles à une biopsie et constitue un outil majeur pour l’évaluation de la réponse au traitement et la stratification du risque. La TEP-FDG doit également être réalisée lorsque l’IRM est contre-indiquée, non contributive ou normale malgré une forte suspicion clinique.
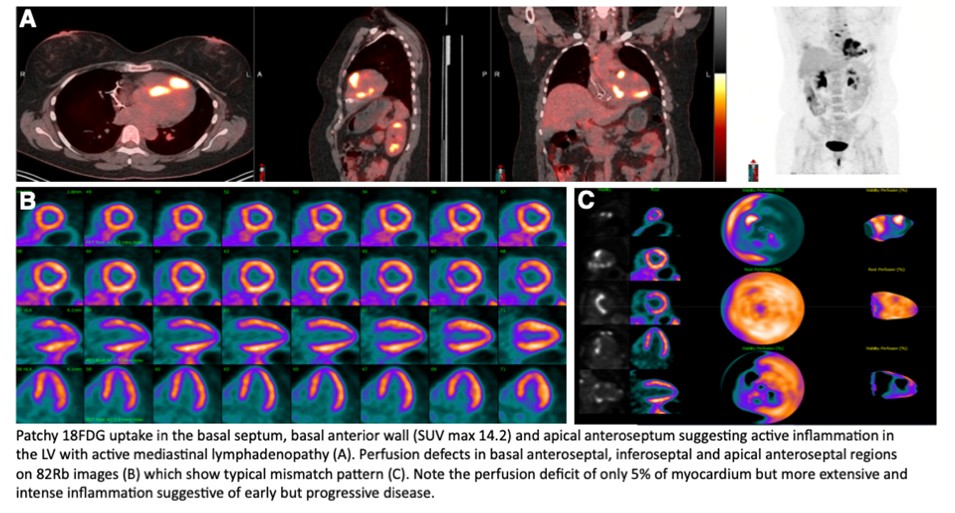
3. Critères diagnostiques de la sarcoïdose cardiaque
Selon les critères de la WASOG (World Association of Sarcoidosis and Other Granulomatous Disorders), le diagnostic de sarcoïdose cardiaque peut être retenu losqu’une inflammation granulomateuse non caséeuse est mise en évidence à la biopsie endomyocardique, après exclusion des diagnostics différentiels, notamment infectieux.
À défaut d’une confirmation histologique cardiaque, le diagnostic est retenu s’il associe :
- Un diagnostic histologique de sarcoïdose extracardiaque,
- Au moins un des critères suivants :
- Une atteinte myocardique ou un BAV répondant au traitement immunosuppresseur,
- Une FEVG < 40 %, ou une TV soutenue, ou un BAV de haut grade, non expliqués,
- Une fixation myocardique « patchy » du FDG au TEP-scan,
- La présence de rehaussement tardif et/ou d’un hypersignal en pondération T2 à l’IRM,
- Une captation positive au gallium-67 (⁶⁷Ga),
- Une anomalie de perfusion à la scintigraphie myocardique,
- Et l’exclusion des diagnostics différentiels.
4. Prise en charge thérapeutique
4.1 Prise en charge des troubles conductifs et rythmiques
La survenue d’un BAV complet ou de troubles du rythme ventriculaire est liée aux lésions myocardiques induites par l’inflammation et la fibrose, qui altèrent l’architecture et les propriétés électrophysiologiques du myocarde. Le contrôle des troubles du rythme fait appel aux bêtabloquants, au sotalol ou à l’amiodarone, tandis que les antiarythmiques de classe I doivent être évités. L’implantation d’un défibrillateur est indiquée selon les critères classiques de prévention primaire et secondaire, et également chez les patients nécessitant une stimulation pour BAV complet ou présentant un rehaussement tardif étendu et persistant à distance de la phase inflammatoire, ceci indépendamment de la FEVG.
4.2. Prise en charge de l’insuffisance cardiaque
L’insuffisance cardiaque constitue une complication majeure de la sarcoïdose cardiaque et représente la manifestation inaugurale chez environ un tiers des patients. Sa physiopathologie est liée au développement d’une fibrose myocardique étendue. Sa prise en charge s’appuie sur les recommandations appliquées aux autres cardiopathies. En cas d’insuffisance cardiaque avancée, la transplantation cardiaque, l’assistance circulatoire mécanique par LVAD ou la prise en charge palliative doivent être discutées.
4.3. Place de l’immunosuppression
L’immunosuppression vise à prévenir l’évolution vers une fibrose myocardique irréversible et une insuffisance cardiaque sévère, avec une efficacité accrue lorsque la FEVG est > 35 %. Une réversibilité des BAV complets récents est possible, tandis que l’effet sur les arythmies ventriculaires est inconstant.
Son instauration est guidée par la démonstration d’une activité inflammatoire myocardique. La corticothérapie constitue le traitement de première intention. Le Méthotrexate ou l’Azathioprine peuvent être utilisés en seconde ligne, tandis que les biothérapies sont réservées aux formes réfractaires.
Conclusion
La sarcoïdose cardiaque est une pathologie complexe, caractérisée par une grande hétérogénéité clinique et un risque non négligeable de mort subite ou d’insuffisance cardiaque avancée. Son diagnostic repose sur une approche multidisciplinaire, et souvent sur l’imagerie cardiaque multimodale. Sa prise en charge est individualisée et combine, selon les présentations, immunosuppression, traitements cardioprotecteurs et antiarythmiques, et recours au défibrillateur implantable chez les patients à risque d’arythmies ventriculaires.
Article rédigé par Claire Baladi
Relecteur : Anner Bernard
- Sharma R, Kouranos V, Cooper LT, Metra M, Ristic A, Heidecker B, et al. Management of cardiac sarcoidosis. Eur Heart J. 2024 Aug 9;45(30):2697–726.
- Sharma R, Kouranos V, Cooper LT, Metra M, Ristic A, Heidecker B, et al. Management of cardiac sarcoidosis. Eur Heart J. 2024 Aug 9;45(30):2697–726.
Article rédigé par Claire Baladi